LAPORAN PRAKTIKUM
NEMATOLOGI PERTANIAN
ACARA II
EKSTRAKSI ISOLASI NEMATODA
Disusun oleh:
Miftachurohman
12/334974/PN/12969
LABORATORIUM NEMATOLOGI
JURUSAN PERLINDUNGAN TANAMAN
FAKULTAS PERTANIAN
UNIVERSITAS GADJAH MADA
YOGYAKARTA
2015
PENDAHULUAN
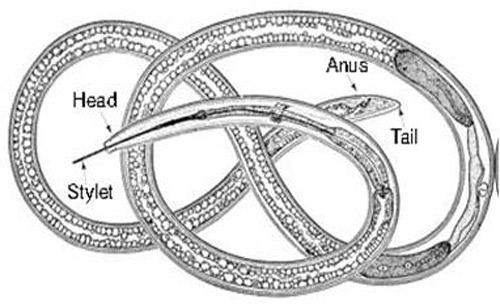
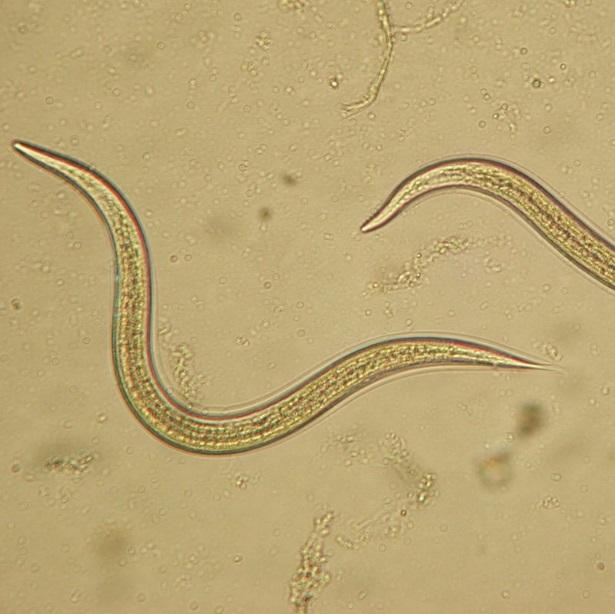
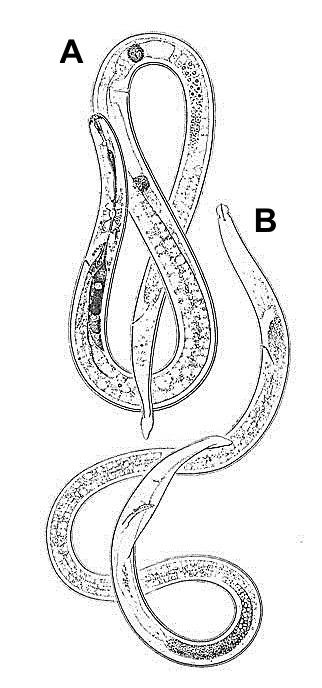
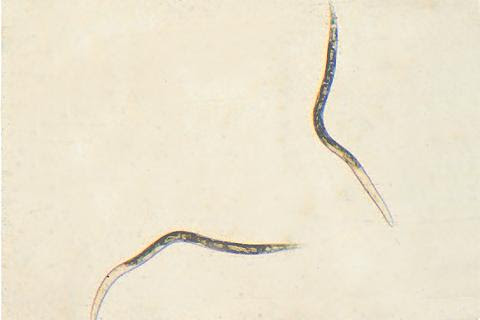
Nematoda merupakan mikroorganisme yang digolongkan ke dalam filum dunia hewan. Ketika dilihat di bawah mikroskop, nematoda terlihat berupa cacing mikroskopis dengan ukuran tubuh yang sangat kecil dan berwarnah bening. Karena ukuran tubuh nemtoda sangat kecil, para petani sangat sulit membedakan dengan penyakit yang disebabkan oleh virus dan bakteri (Prajnanta, 2007).
Nematoda mempunyai saluran usus dan rongga badan, tetapi rongga badan tersebut dilapisi dengan selaput seluler sehingga disebut pseudosel atau pseudoseloma. Tubuh nematoda berbentuk bulat pada potongan melintang, tidak bersegmen, dan ditutupi oleh kutikula. Terdapat sekitar 10.000 jenis nematoda yang hidup di dalam segala jenis habitat mulai dari tanah, air tawar, dan air asin sampai tanaman dan hewan (Norman D. Levine, 1994).
Nematoda merupakan kelompok hewan yang mempunyai ukuran mikron sehingga tidak dapat diamati dengan mata secara langsung dan hanya dapat diamati dengan menggunakan mikroskop. Oleh karena itu, untuk dapat mengamati nematoda maka perlu dilakukan isolasi-ekstraksi nematoda dari habitatnya.
Terdapat beberapa cara untuk mendapatkan nematoda dari dalam sampel tanah dan jaringan tanaman. Nematoda-nematoda yang bergerak aktif dapat diekstraksi dengan menggunakan metode Whitehead tray atau Baermann. Kedua metode ini memberikan hasil yang kurang memuaskan jika digunakan untuk mengekstraksi nematoda yang bergerak lamban atau nematoda yang memiliki ukuran tubuh besar (Suwanda, 2009). Menurut Swibawa et al. (2000), ekstraksi-isolasi nematoda dari dalam akar dapat menggunakan metode Bearmann, sedangkan ekstraksi dan isolasi nematoda dari dalam tanah dapat menggunakan metode dekantasi-sentrifugasi menggunakan larutan gula.
Untuk kegiatan acara parktikum ini, metode yang digunakan adalah Whitehead Tray, Corong Baermann yang diperbaiki, Pengkabutan, metode saring, metode fenwick, dan Sentrifus. Praktikum ini bertujuan untuk memperoleh nematoda dari contoh tanah dan jaringan tanaman, membedakan berbagai macam metode ekstraksi-isolasi nematoda dan mengetahui masing-masing kegunaan metode ekstraksi-isolasi nematoda, serta memperoleh ketrampilan melakukan pekerjaan ekstraksi-isolasi nematoda.
CARA KERJA
Praktikum Nematologi Pertanian acara 2 dengan judul Ekstraksi-Isolasi Nematoda dilaksanakan pada hari Kamis, 17 Maret 2015 di Laboratorium Nematologi, Departemen Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Gadjah Mada, Yogyakarta. Alat yang digunakan adalah sekop kecil, kantung plastik dan alat ekstraksi-isolasi serta perlengkapannya. Bahan yang digunakan berupa contoh tanah dan jaringan tanaman (akar) yang diduga terserang nematoda parasit dari tanaman pisang, terong dan padi.
Metode yang digunakan ada enam macam. Untuk Ekstraksi-Isolasi dari sampel tanah digunakan metode Whitehead Tray yang dimodifikasi, Corong Baermann yang diperbaiki, metode fenwick, dan saring. Metode yang digunakan untuk ekstraksi isolasi dari sampel akar adalah metode Whotehead Tray yang dimodifikasi, metode sentrifuse, dan pengkabutan.
Cara kerja dari metode Whitehead Tray yang dimodifikasi yaitu perlengkapan yang diperlukan disiapkan. Screen nilon dipasang di atas nampan penyangga (dasar nampan berlubang), dan diatasnya diletakkan kertas saring (tissue tanpa parfum) hingga permukaan nampan penyangga tertutup. Diatas permukaan tisu diletakkan gelas arloji agar tanah yang dituangkan tidak merobek permukaan tisu. Contoh tanah yang berada di dalam Waskom diambil 100 ml kemudian di homogenkan dengan air volume kurang lebih 200 ml. Setelah homogeny, suspense tanah kemudian dituangkan diatas gelas arloji secara perlahan. Tanah hasil suspense yang berada di gelas arloji kemudian di ratakan secara perlahan diatas permukaan tisu. Masukkan air ke nampan plastik sampai menyentuh permukaan tanah. Air yang keluar kemudian dibuang, agar hasil suspense yang dipanen menjadi jernih. Selanjutnya didiamkan selama 24 jam dalam temperatur kamar. Setelah itu nampan penyangga dan kelengkapannya serta contoh tanah diangkat dan disingkirkan. Nampan plastik yang berisi air dan nematoda (suspensi nematoda) dituang ke dalam gelas beker. Ditunggu beberapa menit agar nematoda mengendap. Volume air dikurangi dengan pipet (pipa kecil) secara hati-hati, suspensi nematoda disisakan ± 75 ml. Suspensi nematoda yang diperoleh lalu diamati.
Cara kerja dari metode Corong Baermann yang diperbaiki yaitu contoh tanah dicampur secara merata di dalam waskom dan diambil sebanyak 100 ml. Contoh tanah 100 ml disaring dengan saringan berdiameter mata saring 840 µm (dikerjakan pada piring). Partikel kasar pada saringan dibuang. Hasil saringan (dalam piring) dimasukkan ke dalam gelas beker (A) volume 1000 ml. Suspensi tanah dalam gelas beker (A) didekantasi. Cara dekantasi sebagai berikut: Suspensi tanah diaduk hingga merata. Didiamkan selama ± 15 detik, sehingga siperoleh dua endapan (bagian atas dan bawah). Endapan bagian atas dituang ke dalam gelas beker lain (B) untuk memisahkan partikel kasar yang mengendap. Partikel tanah yang tertinggal pada gelas beker (A) ditambah ± 100 ml air, kemudian diaduk dan didiamkan selama ± 15 detik. Endapan bagian atas dituang dijadikan satu dengan gelas beker (B). Hasil dekantasi adalah pada gelas beker (B). Proses dekantasi ini dikerjakan tiga kali. Untuk mengurangi volume air pada suspensi tanah dalam gelas beker (B), didiamkan selama ± 1 menit. Endapan atas disaring dengan saringan bertingkat, Ø mata saringan 45 µm (di atas) dan 35 µm (di bawah). Nematoda yang tertahan pada saringan 45 µm dan 35 µm dimasukkan kembali ke dalam gelas beker (B) dengan bantuan botol semprot. Selanjutnya suspensi tanah yang halus dituangkan di atas kertas saring (tissue tanpa parfum) pada saringan 840 µm di dalam corong Baermann. Dibiarkan selama 24 jam, lalu penepit dibuka dan suspensi nematoda (di dalam corong) diambil sebanyak ± 50 ml yang ditampung dalam botol penyimpan. Suspensi nematoda lalu diamati.
Cara kerja metode Fenwick adalah corong fenwick diatur sedemikian rupa, kemudian tanah disiapkan sebanyak 200-300 ml dan diletakkan diatas saringan diameter 1 mm. Tanah kemudian dicuci dengan menyemprotkan air dari atas tanah. Partikel tanah halus, bahan organic, dan sista akan turun ke dalam corong fenwick, dan melimpah keluar dana akan tertampung pada saringan dengan diameter mata saring 250 mikron. Sista yang tertampung diatas saringan dicuci dengan botolsemprot dan dituangkan diatas tisu. Biarkan beberapa saat hingga keringa angina. Sista kemudian diamati dengan kaca pembesar atau mikroskop dissecting.
Untuk Ekstraksi-Isolasi dari jaringan akar digunakan metode Pengkabutan dan Sentrifus. Cara kerja dari metode Pengkabutan yaitu disiapkan mangkok plastik dengan lubang di tengah dinding. Corong berikut saringan 840 µm ditempatkan di dalam mangkok plastik. Dasar saringan dilapisi kertas saring. Contoh akar yang sudah dicuci ditiriskan dan dikering anginkan. Selanjutnya dipotong-potong ± 0,5 cm. Contoh akar diambil sebanyak 5 gram dimasukkan dan diatur merata di atas kertas saring di dalam saringan dengan diameter mata saringan 840 µm. Mangkok plastik berikut contoh jaringan akar diletakkan ke dalam rak pengkabutan. Rak pengkabutan ditutup dan kran air dibuka selama 48 jam. Suspensi nematoda dalam mangkok plastik dipanen. Suspensi nematode tersebut dipindahkan ke dalam gelas beker selanjutnya dituangkan ke dalam botol penyimpan (warna hitam) atau disimpan di dalam lemari pendingin.
Cara kerja dari metode Sentrifus yaitu contoh jaringan akar dibersihkan dengan air secara hati-hati, kemudian ditiris dan dikering anginkan. Akar dipotong-potong ± 0,5 cm dan diambil sebanyak 5 gram. Ditambahkan air 100 ml dan dicincang dengan blender selama 3 menit. Setelah itu dimasukkan ke dalam tabung sentrifus dan ditambahkan tanah kaolin secukupnya. Tanah kaolin digunakan untuk mengikat jaringan ketika dalam proses sentrifugasi. Masing-masing tabung sentrifus ditimbang untuk mendapatkan berat yang sama dan tabung dipasang di alat sentrifus. Sentrifus diputar dengan kecepatan 5000 rpm selama 5 menit. Air yang ada pada lapisan atas dibuang dan ditambahkan larutas gula pasir (BJ=1,18) dan diaduk hingga merata. Masing-masing tabung dipasang pada alat sentrifus lagi dengan kecepatan 5000 rpm selama 3 menit. Suspensi nematoda dalam larutan gula dituang ke dalam saringan 28 µm dan dicuci dengan air menggunakan botol semprot. Nematoda yang tertampung dalam saringan tersebut dimasukkan ke dalam gelas beker 100 ml dengan bantuan botol semprot. Suspensi nematoda siap diamati.
HASIL DAN PEMBAHASAN
Hasil Pengamatan
| Kelompok | Metode | ||||||
| Baermann yang diperbaiki | Sentrifus | WHT Akar | WHT Tanah | Pengkabutan | Fenwick | Saring | |
| 1 | 53,33 | 12,00 | 86 | 27 | 987 | 121 | 23 |
| 2 | 133,33 | 74,80 | 920 | 186,7 | 1020 | 163 | 26 |
| 3 | 13,4 | 20 | 1566 | 0 | 1293,4 | 162 | 3 |
| Rerata | 65,68 | 29,00 | 857,33 | 71,1 | 11000,13 | 148,65 | 17,33 |
Pembahasan
Ekstraksi-isolasi nematoda adalah suatu proses untuk memisahkan nematoda dari habitat hidupnya, baik dari tanah maupun dari jaringan tanaman sebelum dilakukan kejian lebih lanjut. Kajian lebih lanjut yang dilakukan adalah amtara lain identifikasi dan penghitungan populasi nematoda. Ada beberapa metode yang digunakan dala melakukan ekstraksi isolasi nematoda dari sampel tanah maupu jaringan tanaman, diantaranya adalah corong baermann, whitehead tray, sentrifuse, penyaringan, pegkabutan, dan fenwick. Pemilihan metode yang akan digunakan untuk ekstraksi isolasi nematoda ditentukan dengan ketersediaan fasilitas, objek nematoda yang ditargetkan, ukuran sampel, jumlah sampel, tipe tanah, dan lain sebagainya.
Ada dua jenis bahan yang digunakan dalam praktikum ekstraksi-isolasi nematoda, yaitu tanah dan akar. Metode Ekstraksi-isolasi yang digunakan untuk media tanah adalah dengan menggunakan metode corong baermann yang diperbaiki, metode whitehead tray yang dimodifikasi, dan metode fenwick. Metode yang digunakan untuk ekstraksi-isolasi pada jaringan akar adalah metode sentrifuse, metode pengkabutan, dan whitehead tray yang dimodifikasi.
Di dalam habitatnya, nematoda memanfaatkan air utuk melakukan perpindahan. Cara kerja dari metode ekstraksi isolasi nematoda adalah dengan memanfaatkan filum air untuk mengekstraksi dan mengisolasi nematoda dari tanah atau jaringan tanaman (akar). Tanah yang menjadi tempat hidup nematoda mempunyai struktur yang kasar. Kebanyakan nematoda juga hidup di tanah yang mempunyai banyak pori dan didalam pori-pori tersebut terdapat cukup udara. Tanah tersebut juga mempunyai kelembapan yang cukup serta tipe tanah dan pH juga mempunyai pengaruh terhadap distribusi nematoda.
Dari hasil pengamatan ekstraksi-isolasi dengan menggunakan tujuh metode dan dua macam sampel dapat diketahui bahwa metode ekstraksi isolasi untuk akar paling banyak adalah dengan menggunakan metode pengkabutan, yaitu dengan jumlah rerata 11000,13. Untuk sampel tanah, metode yang menghasilkan nematoda paling banyak adalah metode fenwick, yaitu denganjumlah rerata 148,65 .
Dari hasil pengamatan, maka dapat diketahui bahwa metode pengkabutan cocok digunakan untuk ekstraksi-isolasi nematoda dari sampel akar. Sementara itu, metode fenwick paling cocok digunakan untuk ekstraksi isolasi nematoda dari sampel tanah. Hal ini berdasarkan pada banyaknya jumlah nematoda yang tertangkap.
Menurut Dewi, dkk (2007), pengamatan nematoda dikatakan efektif jika kerapatan nematoda tanah yang ditemukan dari kedalaman tanah 0-5 cm ditemukan rata-rata 67 individu, di kedalaman 5-10 cm ditemukan rata-rata 69 individu, dan di kedalaman 10-15 cm ditemukan rata-rata 46 individu nematoda tanah per 150 cc tanah. Berdasarkan hasil penelitian tersebut dapat dibuktikan bahwa kedalaman tanah yang paling banyak ditemukan nematoda adalah di kedalaman 5-10 cm.
Pada hasil pengamatan menunjukkan hasil yang mempunyai rentan rerata yang sangat jauh berbeda. Pada sampel tanah metode saring memiliki jumlah rerata yang paling rendah, yaitu sebanyak 17,33 sedangkan pada metode whitehead tray memiliki jumlah rerata paling tinggi, yaitu sebanyak 71,1. Pada hasil pengamatan sampel akar, jumlah nematoda tertinggi diperoleh dari hasil metode sentrifuse yaitu sebanyak 2900, sementara itu hasil terendah didapat dari metode whitehead tray yaitu sebanyak 857,33. Dari hasil ini, meskipun dari sampelyang sejenis, namun memiliki jumlah rentan rerata yang sangat jauh berbeda. Hal ini dapat disebabkan karena kurangnya ketrampilan dalam mempraktikan metode sehingga didapatkan bias data yang sangat kontras.
Masing-masing metode mempunyai kelebihan dan kelemahan. Metode whitehead tray cocok dipergunakan untuk mendapatkan bahan inoculum karena hanya nematoda yang hidup, sehat, dan aktif saja yang dapat diisolasi. Nematoda yang aktif pada sampel tanah lama-lama akan menuju ke air yang ada pada nampan plastik. Sehingga kelebihan dari metode ini adalah akan didapatkan nematoda dengan kualitas yang baik dan juga proses serta peralatannya yang sederhana. Kekurangannya adalah metode ini tidak cocok digunakan untuk penghitungan populasi nematoda pada suatu tanah karena seperti telah disebut sebelumnya bahwa nematoda yang didapat hanya yang hidup.
Pada metode Corong Baermann Nematoda bisa didapatkan nemotoda dalam jumlah lebih banyak dan nematoda yang didapat dalam kualitas baik karena masih hidup. Kekurangannya adalah cara kerjanya yang sedikit rumit dan prosesnya yang cukup panjang serta tidak cocok untuk perhitungan populasi pada suatu tanah.
Menurutnya, keuntungan dari metode ini adalah penipisan oksigen dapat dihindari serta efisiensi ekstraksinya lebih tinggi. kekurangan dari metode ini adalah membutuhkan banyak air sehingga boros air dan sulit untuk menjaga sampel bebas dari ganggang dan jamur.
Pada metode Sentrifus, Kelebihan dari metode ini adalah bisa didapatkan nematoda dalam keadaan hidup maupun mati karena hanya mendasarkan pada berat jenis dan bukan pada gerakan nematoda. Kekurangannya adalah peralatan yang digunakan tidak mudah didapat dan harganya mahal.
Pada metode fenwick, kelebihanya adalah penggunaan alat yang sederhana dan praktis, sehingga proses ektraksi isolasi menjadi lebih efisien. Kekurangan dari penggunaan metode ini adalah nematoda yang didapat dalam kondisi yang sudah tidak segar.
Untuk mengekstrasi nematoda yang berasal dari dalam jaringan tumbuhan yang berupa akar harus dibersihkan terlebih dahulu dan dipotong-potong menjadi bagian-bagian kecil dengan panjang 0,5 cm. Untuk metode whitehead tray dan pengkabutan, akar langsung diletakkan secara merata diatas tisu dan diinkubasi selama kurang lebih 24 jam.Pada saat itu, nematoda akan menembus lubang tisu dan tergerak menuju air yang kaya akan oksigen. Untuk metode sentrifuse, akar kemudian dihaluskan dengan menggunakan blender selama kurang lebih 3 menit sehingga akan menghasilkan campuran nematoda,
Setelah proses ekstraksi-isolasi, suspense nematoda yang diperoleh dapat dinyatakan per satuan unit sampel. Untuk jaringan tanaman dapat dinyatakan per satuan berat, misalnya adalah per 5 gram (akar). Untuk sampel tanah, dapat dinyatakan dalam satuan volume, misalnya per 100 ml tanah. Jika hasil ekstraksi nematida didapat dalam jumlah yang kecil, semua nematoda dapat diamati dengan menggunakan mikroskop. Jika perlu, volume airnya dikurangi sebelum diamati dengan cara penyaringan menggunakan saringan 20 mikron atau 35 mikron atau pengetapan dengan menggunakan selang plastic berukuran kecil. Apabila diperoleh nematoda dalam jumlah yang besar, maka suspense nematoda perlu diencerkan terlebih dahulu.
Manfaat dari ekstraksi-isolasi nematoda adalah untuk memisahkan nematoda dari habitatnya yang berupa tanah ataupun jaringan tanaman sehingga selanjutnya dapat dilakukan pengamatan/kajian lebih lanjut seperti identifikasi ataupun penghitungan populasi nematoda pada suatu lahan atau tanaman.
KESIMPULAN
-
- Jumlah nematoda yang diperoleh dari masing masing metode memiliki jumlah rerata yang jauh berbeda. Hal ini dapat disebabkan oleh karena kurangnya ketrampilan sehingga menghasilkan bias data yang sangat tinggi.
- Ada beberapa macam metode yang dapat digunakan dalam ekstraksi-isolasi nematoda. Masing-masing metode memiliki kelebihan dan kelemahan. Masing-masing metode.
- Pemilihan metode yang akan digunakan untuk ekstraksi isolasi nematoda ditentukan dengan ketersediaan fasilitas, objek nematoda yang ditargetkan, ukuran sampel, jumlah sampel, tipe tanah, dan lain sebagainya.
DAFTAR PUSTAKA
Rahmita,Dewi, dkk. 2007. Kerapatan dan Biodiversitas Nematoda Tanah Gambut di Kecamatan Gambut, Kabupaten banjar, Kalimantan Selatan. Jurnal Bioscientiae. 4: 85-86.
Prajnanta, F. 2007. Mengatasi Permasalahan Bertanam Cabai. Depok : Penebar Swadaya
Norman, D.L.. 1994. Buku Pelajaran Parasitologi Veteriner. Gadjah Mada University Press. Yogyakarta.
Swibawa, I. G., I. Amaliah, dan T. N. Aeny. 2000. Pengaruh infestasi nematoda Pratylenchus terhadap pertumbuhan tanaman nenas [Ananas comosus (l.) Merr.]. Jurnal Hama dan Penyakit Tumbuhan Tropika 1: 25-28.