LAPORAN PRAKTIKUM
NEMATOLOGI PERTANIAN
ACARA VI
INTERAKSI TANAMAN INANG DENGAN NEMATODA PARASIT

Disusun oleh:
Miftachurohman
12/334974/PN/12969
LABORATORIUM NEMATOLOGI
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS GADJAH MADA
YOGYAKARTA
2016
PENDAHULUAN
Tomat merupakan komoditas yang banyak dibudidayakan di Indonesia. Permintaan tomat tidak pernah turun. Dalam proses budidaya tomat, petani sering mengalami kendala. Salah satu kendala dalam budidaya tomat adalah adanya serangan nematoda. Nematoda parasitik tanaman merupakan salah satu jenis hama penting, karena menimbulkan kerugian besar pada tanaman dalam sistem produksi pertanian di daerah tropis maupun sub tropis. Serangan nematoda mengakibatkan berkurangnya fungsi akar secara normal, mengakibatkan pengangkutan unsur hara ke bagian jaringan tanaman di atas permukaan tanah makin berkurang (Dropkin, 1991).
Menurut Panggeso (2010) apabila tanaman terinfeksi berat oleh nematoda, sistem perakaran yang normal akan berkurang dan menyebabkan jaringan berkas pengangkut mengalami gangguan secara total, akibatnya tanaman mudah layu khususnya dalam keadaan kering dan tanaman sering menjadi kerdil, pertumbuhan terhambat dan mengalami klorosis.
Beberapa nematoda parasit tanaman adalah ektoparasit, hidup di luar inangnya. Spesies jenis ini menyebabkan kerusakan berat pada akar dan dapat menjadi vektor virus yang penting. Spesies lain, ada yang hidup di dalam akar, bersifat endoparasit migratori dan sedentari. Parasit migratori bergerak melalui akar dan menyebabkan nekrosis, sedangkan yang endoparasit sedentari dari famili Heteroderidae menyebabkan kehancuran yang paling banyak di seluruh dunia (Williamson & Richard, 1996).
Nematoda parasit menyerang pada organ tumbuhan yang vital seperti akar, daun dan bunga. Nematoda parasit umumnya menyerang bagian tanaman yang lunak dengan cara menginfeksinya. Kerusakan terbesar yang disebabkan oleh nematoda parasit adalah hancurnya jaringan pada akar. Pada stadium kronis, tanaman yang diserang oleh nematoda parasit tidak dapat tumbuh, kerdil, mengalami disfungsi organ dan akhirnya mati (Dropkin, 1991 cit. Prabowo, 2012).
Meloidogyne sering disebut root-knot nematodes atau nematoda puru akar karena menyebabkan terjadinya puru atau bengkak pada akar yang terserang nematoda tersebut. Dalam satu siklus hidup Meloidogyne terjadi perubahan morfologis yaitu bentuk telur, larva (juvenil), dan dewasa (jantan serta betina) (Mulyadi, 2009).
Pada acara praktikum ini, dilakukan kegiatan inokulasi tanaman tomat dengan larva Meloidogyne incognita dan kemudian tanaman diamati dengan periode 2 kali dalam 49 hari hari setelah tanam. Tujuan dari praktikum ini adalah untuk mempelajari perkembangan gejala dan tanda serangan nematoda parasit tumbuhan, mengetahui kerusakan tanaman akibat serangan nematoda parasit tumbuhan, dan mengetahui cara menilai kerusakan akar akibat serangan nematoda puru akar dengan skor menurut Zeck.
CARA KERJA
Praktikum Nematologi Pertanian acara 5 dengan judul Interaksi Tanaman Inang dengan Nematoda Parasit dilaksanakan pada hari Kamis, 3 Maret 2016 hingga Kamis, 28 April 2016 di Laboratorium dan Rumah Kaca Nematologi, Departemen Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Gadjah Mada, Yogyakarta. Alat yang digunakan berupa besek, pot Ø 12,5 cm, alat ukur panjang/lebar, timbangan dan mikroskop. Bahan yang digunakan berupa benih tomat, tanah steril, pupuk kompos, bahan inokulum (larva nematoda Meloidogyne incognita) dan air.
Cara yang dilakukan dalam praktikum ini yaitu mula-mula benih tomat ditanam pada tanah steril di dalam besek untuk memperoleh bibit umur 21 hari. Bibit tomat umur 21 hari (sebanyak 1 batang) ditanam pada media steril (3 bagian tanah dan 1 bagian pupuk kompos steril) dalam masing-masing pot. Disiapkan tanaman umur 7 hari setelah tanam (hst) sejumlah 36 pot. Kemudian separo jumlah tanaman diinokulasi 20.000 ekor larva nematoda M. incognita untuk setiap pot tanaman dan separo jumlah tanaman yang lain tidak diinokulasi nematoda atau sebagai pembanding (18 pot untuk perlakuan inokulasi nematoda dan 18 pot untuk perlakuan tanpa inokulasi nematoda, 4 pot pada masing-masing perlakuan untuk cadangan). Pengamatan dilakukan sebanyak 2 kali dengan interval waktu 14 hari yaitu dengan mengamati 7 tanaman untuk masing-masing perlakuan. Pengamatan pertama dimulai pada tanaman umur 14 hari setelah inokulasi (hsi) atau 21 hst. Pengamatan kedua pada tanaman umur 35 hsi atau 42 hst. Parameter pengamatan meliputi: tinggi tanaman, panjang akar, berat bagian tanaman di atas permukaan tanah (berat brangkasan basah), warna daun, kerusakan akar (menggunakan skor Zeck), dan jumlah puru pada akar.
HASIL DAN PEMBAHASAN
Hasil
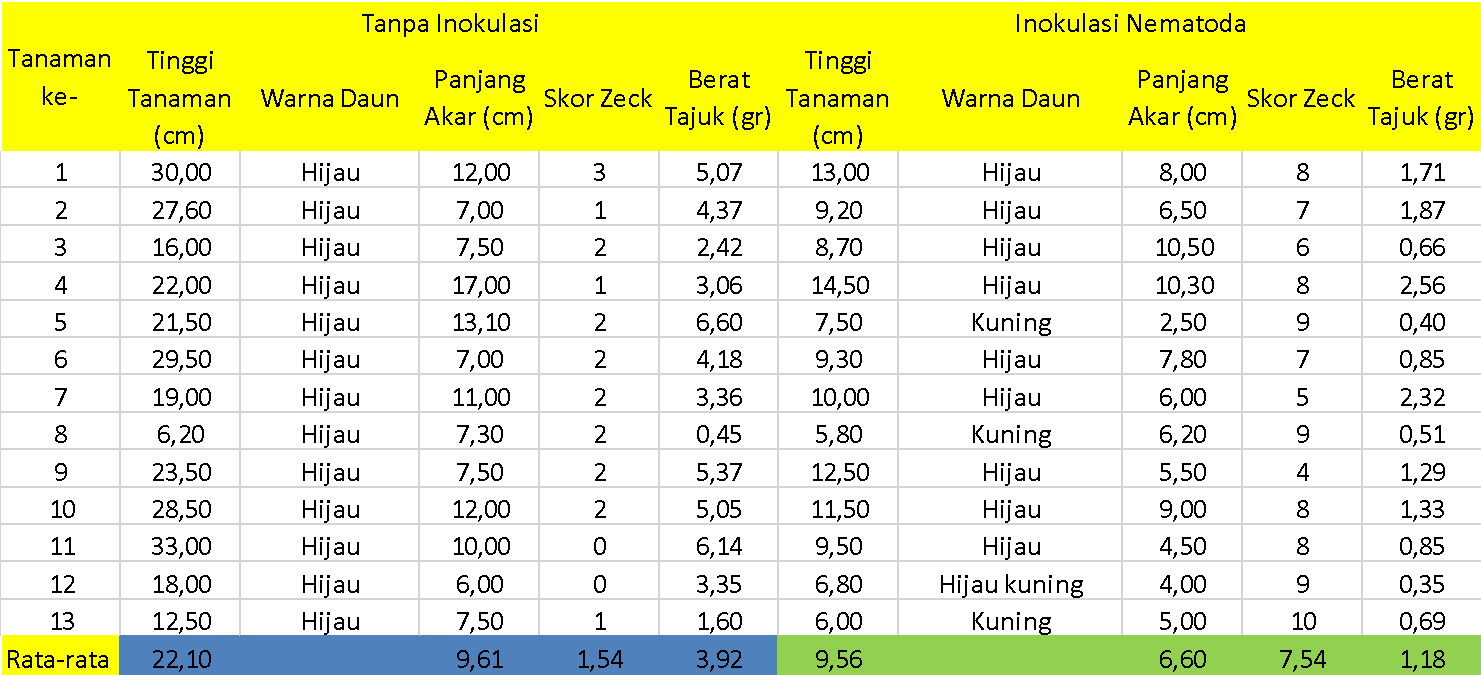
Gambar 1. Tabel hasil pengamatan tanaman tomat selama 14 HIS
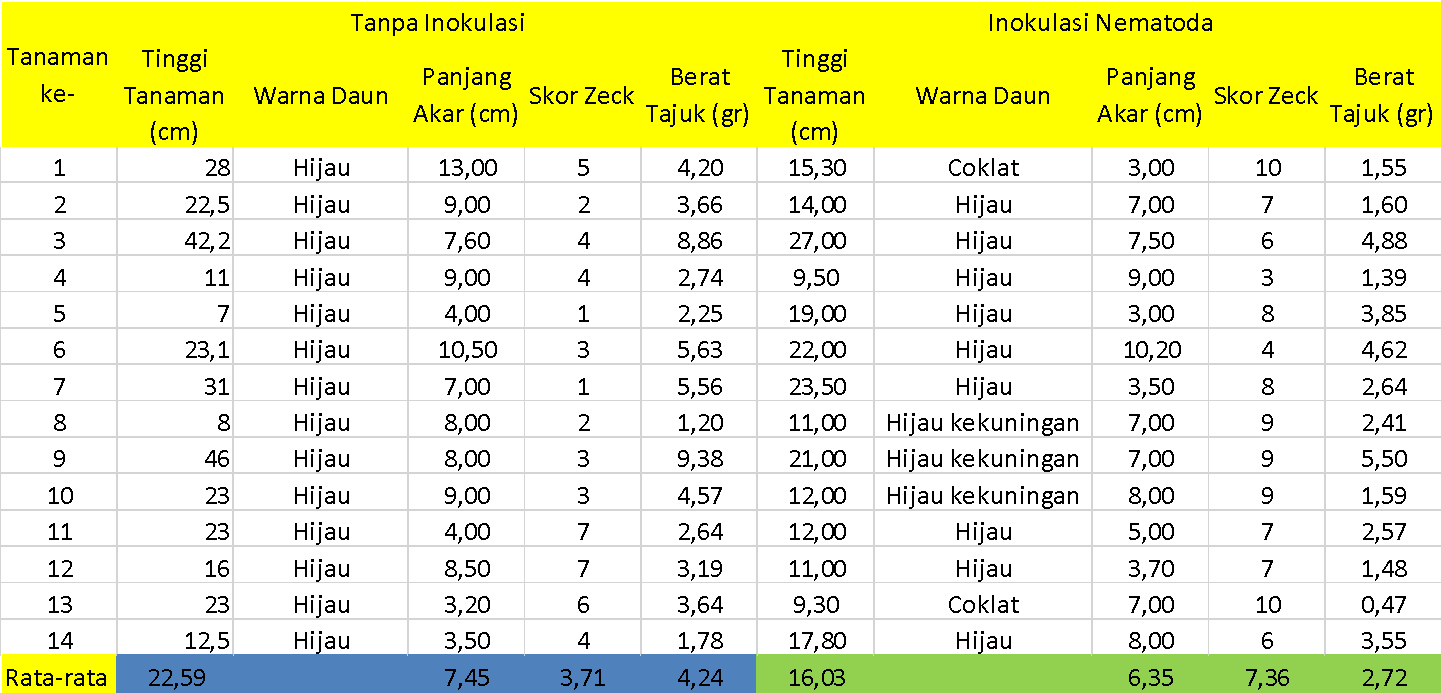
Gambar 2. Tabel hasil pengamatan tanaman tomat selama 28 HSI
Pembahasan
Pada praktikum ini dilakukan inokulasi nematoda Meloidogyne incognita pada tanaman tomat berumur 28 hari setelah tanam benih. Kemudian diamati perubahan pertumbuhan tanaman setiap 14 hari selama 2 kali pengamatan (14 hari dan 28 hari setelah inokulasi/hsi). Parameter pengamatan meliputi: tinggi tanaman, panjang akar, berat bagian tanaman di atas permukaan tanah (berat brangkasan basah), warna daun, kerusakan akar (menggunakan skor Zeck), dan jumlah puru pada akar.
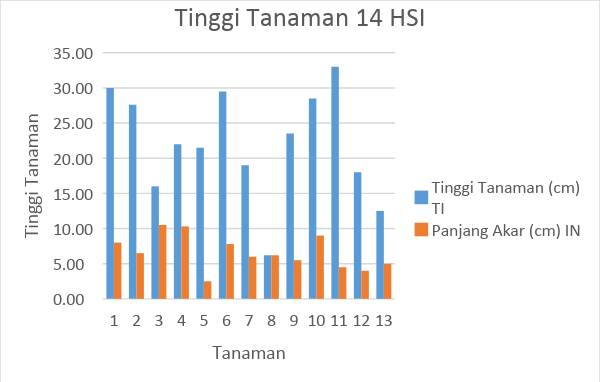
Gambar 3. Tabel hasil pengamatan tinggi tanaman tomat selama 14 HSI
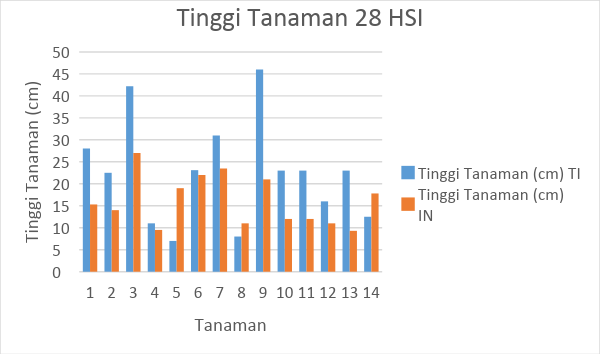
Gambar 4. Tabel hasil pengamatan tinggi tanaman tomat selama 14 HSI
Dari hasil pengamatan selama 14 HSI dapat diketahui bahwa rata-rata tinggi tanaman tomat tanpa inokulasi yaitu sepanjang 22,10 cm, sementara itu rata-rata tinggi tanaman tomat dengan inokulasi nematoda yaitu sepanjang 9,56 cm. Sementara itu, pada tanaman tomat tanpa inokulasi yang diamati pada 28 HIS mengalami pemanjangan akar menjadi 22,59 cm dan tinggi tanaman yang diinokulasi memiliki tinggi tanaman 16.03 cm.
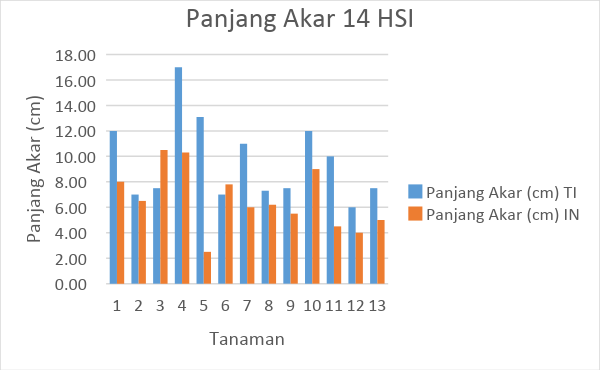
Gambar 5. Tabel hasil pengamatan panjang akar tanaman tomat selama 14 HSI
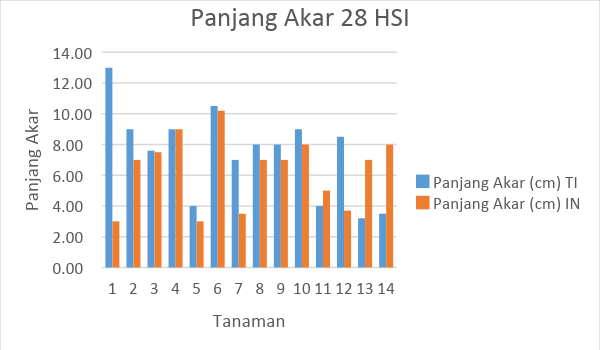
Gambar 6. Tabel hasil pengamatan panjang akar tanaman tomat selama 28 HSI
Dari hasil pengamatan dapat diketahui bahwa rata-rata panjang akar mengalami penurunan. Penurunan panjang akar ini terjadi pad 14 HSI dan 28 HSI. Penurunan panjang akr ini diduga karena terjadinya intensitas serangan yang semakin banyak. Pada tanaman tomat tanpa inokulasi bahkan ditemukan beberapa gall dengan tingkat keparahan yang ringan.
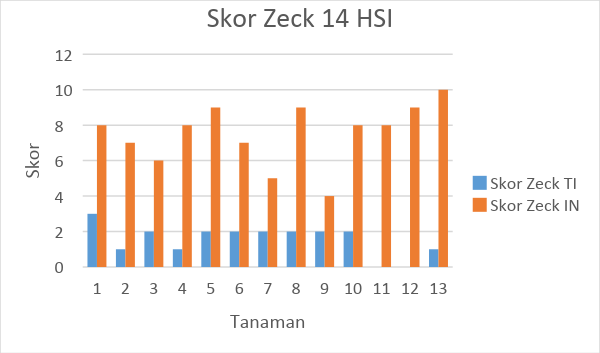
Gambar 7. Tabel hasil pengamatan skor zeck tanaman tomat selama 14 HSI
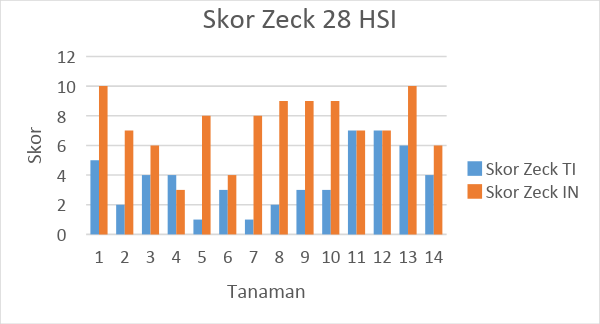
Gambar 8. Tabel hasil pengamatan skor zeck tanaman tomat selama 28 HIS
Skor zeck menunjukkan keparahan intensitas serangan nematoda yang diukur pad tingkat keparahan nematoda menyerang bagian akar tanaman. Pada tanaman tanoa inokulasi nematoda terlihat bahwa tanaman memiliki skor zeck yang rendah yang berarti bahwa kondisi perakaran tanaman tomat sehat. Skor pada 14 HIS tanpa inokulasi menunjukkan rata-rata 1,54 dan pada 28 HSI menunjukkan angka 3,71. Pada penamatan akar dengan inokulasi nematoda menunjukkan skor pada pengamatan 14 HSI dan 28 HSI berturut-urut 7,54 dan 7,38. Rata rata keparahan tingkat serangan ini relatif mendekati sama.
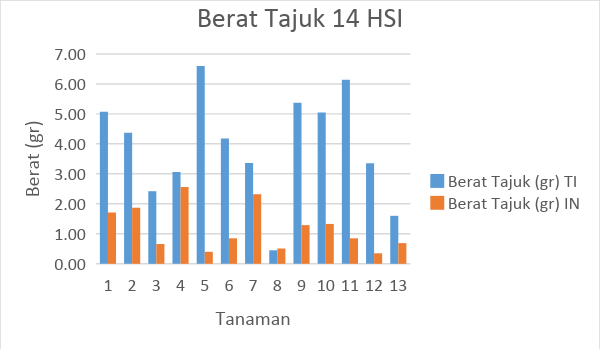
Gambar 9. Tabel hasil pengamatan berat tajuk tanaman tomat selama 14 HSI
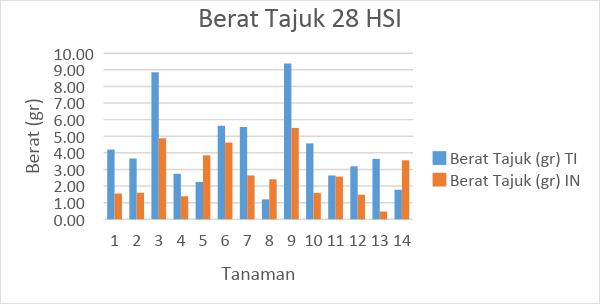
Gambar 10. Tabel hasil pengamatan berat tajuk tanaman tomat selama 28 HSI
Berat tajuk menunjukkan timbunan asimilat tanaman hasil fotosintesis yang dapat disimpan oleh tanaman tomat. Dari hasil perhitungan berat tajuk dapat diketahui bahwa rata-rata berat tajuk mengalami kenaikan pada pengamatan 14 HSI dan 28 HSI. Rata-rata kenaikan berat tajuk tanpa inokulasi pada 14 HSI dan 28 HSI adalah 3,92 gr dan 4,24. Pada tanamn tomat yang diinokulasi menunjukkan kenaikan berat tajuk pada pengamatan 14 HIS dan 28 HIS berturut-urut sebesar 1,18 gr dan 2,72 gr.
Kerusakan jaringan akar akibat serangan Meloidogyne spp. dapat menghambat penyerapan dan translokasi nutrisi serta air dari akar, sehingga terjadi defisiensi pada daun (antara lain N, P, K, Ca, Mg, dan Fe). Namun sebaliknya terjadi akumulasi nutrisi dalam akar yang mungkin disebabkan karena: peningkatan absorbsi oleh akar, terjadi hambatan translokasi nutrisi ke daun, serta mobilisasi nutrisi ke dalam akar. Mobilisasi nutrisi ke dalam akar disebabkan terjadinya fenomena zink dalam akar (terjadinya hipertrofi dan hyperplasia sel-sel akar serta kebutuhan nutrisi yang tinggi nematoda puru akar untuk bereproduksi) (Mulyadi, 2009).
Gejala serangan khas akibat serangan Meloidogyne spp. yaitu terbentuknya puru pada akar, pertumbuhan terhambat tanaman dapat kerdil, klorosis, dan pada cuaca terik matahari tanaman cepat layu dibanding yang sehat. Pada tanaman terserang Meloidogyne spp. Laju fotosintesis terhambat, antara lain disebabkan karena: adanya hambatan aliran nutrisi dan air ke daun, terjadinya klorosis, dan terjadinya penutupan stomata daun (tanaman layu) (Mulyadi, 2009).

Gambar: (Kiri) Tanaman tomat yang tidak diinokulasi suspense nematoda (Kanan) Tanaman tomat yang diinokulasi suspense nematoda
Mekanisme penyerangan oleh Meloidogyne spp dimulai dengan masuknya nematoda kedalam akar tumbuhan melalui bagian-bagian epidermis yang terletak dekat tudung akar. Nematoda ini mengeluarkan enzim yang dapat menguraikan dinding sel tumbuhan terutama terdiri dari protein, polisakarida seperti pektin sellulase dan hemisellulase serta patin sukrosa dan glikosid menjadi bahan-bahan lain. Meloidogyne spp mengeluarkan enzim sellulase yang dapat menghidrolisis selulosa enzim endopektin metal transeliminase yang dapat menguraikan pektin. Dengan terurainya bahan-bahan penyusun dinding sel ini maka dinding sel akan rusak dan terjadilah luka. Selanjutnya nematode ini bergerak diantara sel-sel atau menembus sel-sel menuju jaringan sel yang terdapat cukupcairan makanan, kemudian menetap dan berkembang biak kemudian nematoda tersebut masih mengeluarkan enzim proteolitik dengan melepaskan IAA ( Asam indol asetat) yang merupakan heteroauksin tritopan yang diduga membantu terbentuknya puru.
Pada akar tanaman yang terserang menjadi bisul bulat atau memanjang dengan besar bervariasi. Di dalam bisul ini terdapat nematoda betina, telur dan juvenil. Bisul akar yang membusuk akan membebaskan nematoda dan telurnya ke dalam tanah kemudian masuk kedalam akar tanaman lain. Ukuran dan bentuk puru tergantung pada spesies, jumlah nematoda didalam jaringan, inang dan umur tanaman.
Apabila tanaman terinfeksi berat oleh Meloidogyne sistem akar yang normal berkurang sampai pada batas jumlah akar yang berpuru berat dan menyebabkan sistem pengangkutan mengalami disorganisasi secara total. Sistem akar fungsinya benar benar terhambat dalam menyerap dan menyalurkan air maupun unsur hara. Tanaman mudah layu, khususnya dalam keadaan kering dan tanaman sering menjadi kerdil (Luc et al, 1995).
Gejala serangan lainnya yang terjadi di bawah tanah antara lain adalah bintil-bintil akar, luka pada akar, nekrosis pada permukaan akar, percabangan yang berlebihan, dan ujung akar yang tidak tumbuh. Setelah Meloidogyne makan pada ujung akar tersebut sering kali berhenti tumbuh, namun demikian akar belum tentu mati. Serangan pada tanaman tomat terutama terjadi pada tanah yang bertekstur kasar atau berpasir. Disamping memperlemah tanaman, nematoda ini dapat juga menurunkan produksi. Pada populasi yang tinggi dapat menyebabkan kehilangan hasil sebanyak 25-50% (Mustika, 1992).
KESIMPULAN
- Gejala dan tanda serangan nematoda parasit tumbuhan Meloidogyne spp. atau dalam hal ini M. incognita berupa terbentuknya puru pada akar, pertumbuhan tanaman terhambat, klorosis pada daun dan tanaman menjadi layu.
- Kerusakan yang terjadi pada tanaman yang terserang nematoda parasi Meloidogyne terjadi pada akar yang kemudian berimbas pada bagian tanaman di atasnya (tajuk/brangkasan).
- Kerusakan akar akibat serangan nematoda Meloidogyne dapat dinilai menggunakan skor Zeck.
DAFTAR PUSTAKA
Dropkin V.H. 1991. Pengantar Nematologi Tumbuhan. Gajah Mada University Press, Yogyakarta
Luc, M, RA Sikora and J Bridge. 1995. Nematoda Parasitik Tumbuhan di Pertanian Subtropik dan Tropik. Gajah Mada University Press, Yogyakarta
Mulyadi. 2009. Nematologi Pertanian. Gadjah Mada University Press, Yogyakarta.
Mustika, I., 1992. Pengantar Nematologi Tanaman. Balai Penelitian Tanaman Rempah dan Obat Bogor.
Panggeso, J. 2010. Analisis kerapatan populasi nematoda parasitik pada tanaman tomat (Lycopersicum esculentum Mill.) Asal Kabupaten Sigi Biromaru. J Agroland 17: 198- 204
Prabowo, H. 2012. Jenis nematoda yang ditemukan pada tanaman bawang merah (Allium ascalonicum) dan rhizosfer sekitarnya di area persawahan Niten, Bantul, Yogyakarta. AGROVIGOR 5: 75-79.
Rahayu, B dan A. Mukidjo. 1977. Survai populasi nematoda puru akar (Meloidogyne spp) pada pertanaman solanaceae di daerah Istimewa Yogyakarta. Fakultas Pertanian Universitas Gajah Mada. Yogyakarta 10 hal.
Williamson, V. M. and S. H. Richard. 1996. Nematode pathogenesis and resistance in plant. The Plant Cell 8 : 1735-1745.
LAMPIRAN
Gambar 2. Skala Zeck
| Nilai Skala |
Keterangan |
| 0 |
Seluruh akar sehat, tidak ada infeksi atau serangan |
| 1 |
Kelihatan ada puru kecil yang agak sukar diamati |
| 2 |
Terdapat puru kecil yang mudah diamati |
| 3 |
Terdapat puru kecil yang banyak dan masih berkembang, fungsi akar belum kelihatan terganggu |
| 4 |
Terdapat puru kecil yang banyak, puru besar mulai terbentuk, sebagian besar akar masih berfungsi |
| 5 |
Kurang lebih 25% akar tidak berfungsi dan terdapat puru banyak |
| 6 |
Kurang lebih 50% akar tidak berfungsi dan terdapat puru banyak |
| 7 |
Kurang lebih 75% akar tidak berfungsi dan terdapat puru banyak |
| 8 |
Seluruh akar terserang berat, tetapi tanaman masih hidup |
| 9 |
Seluruh puru pada akar membusuk, tanaman layu |
| 10 |
Seluruh akar dan tanaman mati |